Headline
Bukan saat yang tepat menaikkan iuran JKN ketika kondisi ekonomi masyarakat masih hadapi tekanan.
Bukan saat yang tepat menaikkan iuran JKN ketika kondisi ekonomi masyarakat masih hadapi tekanan.
 Kumpulan Berita DPR RI
Kumpulan Berita DPR RI
UNTUK mengetahui cara atom-atom dapat berikatan, kamu harus mempelajari susunan elektron di dalam suatu atom atau yang disebut konfigurasi elektron. Sebagaimana dijelaskan pada model atom Bohr, elektron bergerak mengelilingi inti atom menurut tingkat-tingkat energi tertentu yang disebut sebagai kulit-kulit atom.
Tingkat energi dalam suatu atom berturut-turut dilambangkan dengan K untuk kulit atom pertama (n=1), L untuk kulit atom kedua (n=2), M untuk kulit atom ke tiga (n=3), dan seterusnya. Berikut uraian tentang konfigurasi elektron yang dikutip dari buku Ilmu Pengetahuan Alam/Kementerian Pendidikan dan Kebudayaan Untuk SMP/MTs Kelas IX Semester 2 yang ditulis Siti Zubaidah dkk.
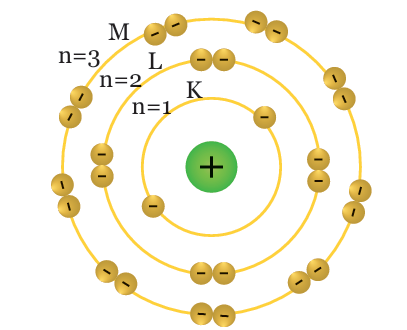
Keterangan gambar: Kulit-kulit atom dan jumlah elektron maksimal yang dapat menempati kulit tersebut.
Agar kamu lebih mudah mempelajari susunan elektron dalam suatu atom, kita gunakan istilah kulit-kulit atom sebagaimana teori Bohr untuk tingkat-tingkat energi. Dengan demikian suatu atom akan punya kulit K, kulit L, kulit M, dan seterusnya.
Tiap-tiap kulit atom ditempati oleh sejumlah elektron. Setiap kulit punya jumlah maksimum elektron yang dapat menempatinya.
Misalnya kulit K, maksimum hanya dapat ditempati oleh 2 elektron. Apabila atom tersebut punya elektron lebih dari 2, elektron berikutnya akan menempati kulit yang berikutnya. Posisi elektron pada kulit-kulit atom dimulai dari kulit terdalam atau yang mempunyai energi paling rendah.
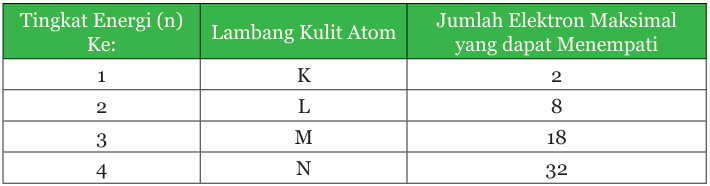
Keterangan tabel: Kulit atom dan jumlah elektron yang dapat menempati kulit tersebut.
Berdasarkan tabel di atas, perhatikan jumlah elektron pada tiap-tiap kulit beberapa atom berikut.
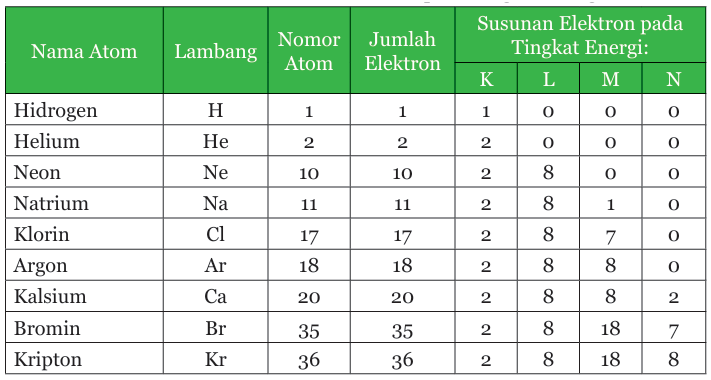
Keterangan tabel: Susunan elektron atom pada tingkat energi.
Posisi elektron secara berurutan dimulai dari kulit K, kemudian ke kulit atom yang lebih tinggi. Pada contoh di atas, atom helium (He), natrium (Na), dan klor (Cl), punya konfigurasi electron sesuai dengan urutan jumlah elektron yang dapat menempati kulit K, L, dan M.
Pada atom Ca yang punya 20 elektron, kulit atom K dan L berturut-turut ditempati oleh 2 dan 8 elektron sehingga tersisa 10 elektron. Walaupun kulit M dapat ditempati 18 elektron, tetapi jumlah elektron yang tersisa hanya 10.
Karena itu, sebanyak 8 elektron akan menempati kulit M terlebih dahulu dan 2 elektron akan menempati kulit N. Hal ini disebabkan penempatan 8 elektron pada kulit M dan 2 elektron pada kulit N lebih stabil dibandingkan penempatan 10 elektron sekaligus pada kulit M.
Apabila jumlah elektron yang tersisa setelah K dan L lebih dari 18 electron, kulit atom M akan ditempati 18 elektron. Perhatikan contoh konfigurasi atom bromin dan kripton. Intinya, elektron akan berada pada setiap kulit hingga membentuk susunan yang paling stabil. (Z-2)
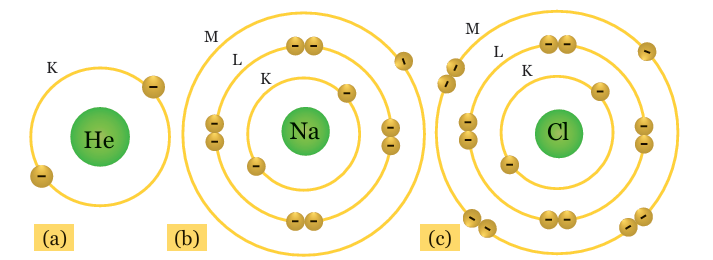
Keterangan gambar: Konfigurasi elektron pada atom H, atom Na, dan atom Cl.
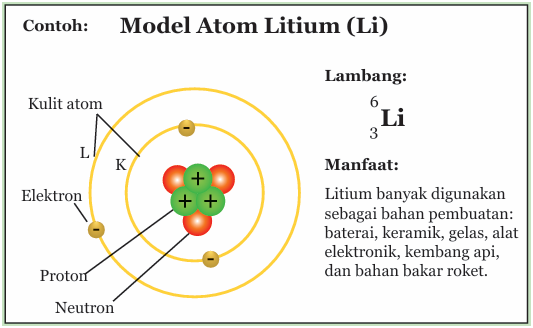
Keterangan gambar: Model atom Litium (Li).
Studi terbaru dari STP-Sat6 mengungkap elektron berenergi rendah jadi pemicu utama pelepasan listrik satelit. Temuan ini bisa jadi dasar sistem peringatan dini.
Elektron: partikel kecil penyusun atom yang punya peran besar dalam listrik, teknologi, dan kehidupan sehari-hari. Pelajari lebih lanjut!
Untuk mengingat kembali inti pelajaran tersebut, berikut rangkuman Bab 8 tentang Partikel Penyusun Benda dan Makhluk Hidup. Silakan disimak kembali.
Observatorium HESS di Namibia berhasil mendeteksi elektron kosmik paling energik yang pernah diamati, dengan energi hingga 40 TeV.
ATOM-ATOM dengan nomor atom 1 sampai 18 akan stabil bila kulit atom terluarnya berisi 8 elektron. Unutk itu, suatu atom dapat melepaskan atau menerima satu atau lebih elektron.
Ingin tahu ringkasan IPA kelas 9? Berikut rangkumannya.
Apa saja garis besar pelajaran IPA kelas 8? Berikut rangkumannya.
Nah, apa saja rangkuman pelajaran IPA kelas 7 SMP? Berikut uraiannya.
KALI ini kita mempelajari pelajaran Kimia untuk siswa SMA kelas 12 atau XII. Sebelum itu, seyogianya kita mengetahui rangkuman atau garis besar pelajaran Kimia untuk kelas 12.
Kalau siswa dapat memahami, tentu menyenangkan mempelajari Kimia. Apa saja Kimia yang dipelajari para siswa di SMA kelas 11? Berikut rangkumannya.
SISWA sekolah menengah atas kelas 11 atau XI akan mempelajari pelajaran Biologi secara khusus. Ada sejumlah bab dan pembahasan dalam pelajaran Biologi yang mesti dipahami siswa SMA kelas 11.
Copyright @ 2026 Media Group - mediaindonesia. All Rights Reserved
