Headline
Bukan saat yang tepat menaikkan iuran JKN ketika kondisi ekonomi masyarakat masih hadapi tekanan.
Bukan saat yang tepat menaikkan iuran JKN ketika kondisi ekonomi masyarakat masih hadapi tekanan.
 Kumpulan Berita DPR RI
Kumpulan Berita DPR RI
MASIH ingatkah kamu dengan materi tentang unsur? Unsur merupakan zat murni yang tidak dapat diubah lagi menjadi zat lain dengan reaksi kimia, seperti emas, besi, perak, oksigen, dan masih banyak yang lain. Saat ini ada sekitar 105 unsur yang ditemukan di alam. Masing-masing unsur memiliki karakteristik yang berbeda-beda.
Atom-atom dari unsur yang berbeda memiliki jumlah partikel subatom yang berbeda. Semua atom dalam suatu unsur yang sama memiliki jumlah proton yang sama di dalam intinya. Jumlah proton ini unik untuk setiap unsur dan dijadikan sebagai dasar nomor atom.
Sementara nomor massa suatu atom ditentukan oleh jumlah neutron dan proton. Atom yang satu berbeda dengan atom yang lain karena punya jumlah elektron, proton, dan neutron yang berbeda. Berikut paparan lebih lanjut yang dilansir dari Buku Ilmu Pengetahuan Alam/Kementerian Pendidikan dan Kebudayaan Untuk SMP/MTs Kelas IX Semester 2 yang ditulis Siti Zubaidah dkk.
Jika dua atom punya massa atom berbeda, jari-jari kedua atom itu akan berbeda pula. Oleh sebab itu, atom H, O, dan C punya ukuran yang berbeda. Hubungan nomor atom, nomor massa, dan jumlah neutron dalam suatu atom yang netral (tidak bermuatan) dapat dituliskan dengan persamaan berikut.
Nomor atom = Jumlah proton (p) = jumlah elektron (e)
Nomor massa = Jumlah proton (p) + Jumlah neutron (n)
Setiap unsur dituliskan dengan lambang unsur. Pada penulisan lambang unsur, nomor atom ditulis sebagai subscript (turun) di kiri lambang unsur. Sedangkan nomor massa ditulis sebagai superscript (naik) di kiri atas lambang unsur, sebagaimana berikut.
X = lambang unsur.
A = nomor massa.
Z = nomor atom.
Sebagai contoh, penulisan lambang unsur litium (Li) yang punya nomor atom 3 dan nomor massa 7 yaitu ![]() .
.
Sebagian besar unsur yang ada di alam sangat penting untuk kehidupan. Namun, ada beberapa unsur yang disebut logam berat, berbahaya bagi tubuh manusia dan lingkungan. Unsur ini tidak dapat didaur ulang dalam tubuh dan sulit untuk dikeluarkan, karena dalam tubuh kita tidak ada mekanisme yang berfungsi untuk menghilangkan unsur ini.
Logam berat mampu bertahan dalam tubuh sepanjang hayat kita. Konsentrasi logam berat dalam tubuh dapat bertambah sepanjang waktu atau dikenal dengan bioakumulasi.
Logam berat dapat menyebabkan berbagai penyakit, seperti kanker dan bahkan dapat menyebabkan kematian. Seorang wanita yang hamil juga dapat mengalami keguguran dan melahirkan bayi yang cacat akibat kandungan logam berat yang cukup tinggi dalam tubuhnya.

Keterangan gambar: Beberapa contoh unsur (a) Merkuri (Hg), (b) Litium (Li), (c) Bromin (Br2), (d) Klorin (Cl2).
Musibah Minamata
Pernahkah kamu mendengar musibah Minamata? Gejala Minamata pertama kali diidentifikasi pada 1956 di teluk Minamata, Jepang. Di teluk Minamata ini terdapat pelabuhan ikan, pabrik pupuk, dan senyawa kimia lain yang dalam prosesnya menggunakan merkuri (Hg).
Suatu ketika merkuri ini bocor dan masuk ke lautan sehingga mengontaminasi ikan dan hewan laut lain. Masyarakat sekitar yang mengkonsumsi ikan yang terkontaminasi merkuri mengalami bioakumulasi merkuri dalam tubuhnya. Bioakumulasi merkuri ini menyebabkan keterbelakangan mental, cacat lahir, buta dan tuli, serta
menyebabkan kematian.
Kejadian musibah Minamata membuat perhatian warga dunia untuk lebih menjaga lingkungan dari pencemaran, khususnya pencemaran logam berat. Teluk Minamata akhirnya ditetapkan bebas merkuri pada Juli 1997 (41 tahun kemudian) dan warga sekitar dapat beraktivitas secara normal baik untuk menangkap ikan maupun berenang di laut.
Baca juga : Teori Atom Fondasi Ilmu Kimia yang Harus Diketahui
Pernahkah kamu mendengar tentang arkeolog? Arkeolog merupakan ilmuwan yang mempelajari sejarah kehidupan dan kebudayaan zaman dahulu. Arkeolog mampu mengukur umur fosil yang telah ditemukan.
Tahukah kamu bagaimana cara mengukur umur fosil tersebut? Cara mengukur umur fosil adalah dengan mengidentifikasi atom karbon yang terkandung dalam fosil. Di alam terdapat tiga jenis atom karbon yaitu
![]() ,
, ![]() , dan
, dan![]() .
.
Ketiga jenis atom C tersebut punya nomor atom sama yaitu nomor 6 tetapi nomor massa berbeda. Atom-atom yang demikian disebut isotop. Perbandingan jumlah ketiga isotop karbon di alam tetap.
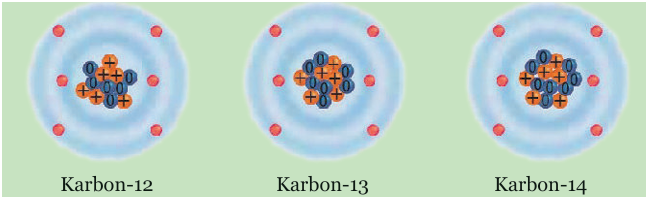
Keterangan gambar: Isotop-isotop atom karbon-14.
Isotop karbon-14 atau ![]() dapat meluruh menjadi unsur lain dengan waktu paruh 5.730 tahun. Artinya kalau kamu punya isotop karbon-14 sebanyak 1,0 gram, setelah 5.730 tahun isotop itu tinggal 0,50 gram (separuh dari jumlah awal) karena meluruh menjadi unsur lain. Karbon-14 sangat reaktif sehingga mudah bergabung dengan oksigen menghasilkan gas karbon dioksida.
dapat meluruh menjadi unsur lain dengan waktu paruh 5.730 tahun. Artinya kalau kamu punya isotop karbon-14 sebanyak 1,0 gram, setelah 5.730 tahun isotop itu tinggal 0,50 gram (separuh dari jumlah awal) karena meluruh menjadi unsur lain. Karbon-14 sangat reaktif sehingga mudah bergabung dengan oksigen menghasilkan gas karbon dioksida.
Jumlah karbon-14 pada tumbuhan dan hewan adalah tetap selama masih hidup. Karbon-14 pada tumbuhan dan hewan yang mati akan berkurang sebanding dengan waktu paruhnya.
Dengan menggunakan perbandingan jumlah karbon-14 yang masih tinggal pada tumbuhan atau hewan yang mati dengan jumlah karbon-12 yang ada di atmosfer, umur fosil tumbuhan atau fosil hewan tersebut dapat ditentukan. Nah, sekarang coba kamu hitung berapa umur fosil Dinosaurus yang awalnya memiliki 128 gram isotop karbon-14 dan sekarang tinggal 2 gram.
Baca juga : Perkembangan Lima Teori Atom oleh para Ilmuwan
Tahukah kamu bahwa zat iodin (I) merupakan komponen hormon tiroksin yang diproduksi oleh kelenjar tiroid. Hormon tiroksin memiliki beberapa fungsi penting, antara lain meningkatkan laju metabolisme untuk menghasilkan energi, mengatur pertumbuhan dan perkembangan sistem saraf dan sistem rangka (otot dan tulang),
serta menjaga tekanan darah.
Mengonsumsi iodin sebanyak 0,15 mg setiap hari sudah cukup untuk memenuhi kebutuhan kelenjar tiroid manusia untuk menghasilkan hormon tiroksin yang diperlukan tubuh. Kekurangan iodin dalam makanan mengakibatkan kelenjar tiroid membesar sampai ukuran abnormal atau yang dikenal dengan penyakit gondok.
Agar dapat mengatasi penyakit tersebut, saat ini iodin dalam bentuk kalium iodat (KIO3) atau kalium iodida (KI) banyak ditambahkan pada garam dapur atau yang biasa kita kenal dengan garam beriodium. (Z-2)
Studi terbaru dari STP-Sat6 mengungkap elektron berenergi rendah jadi pemicu utama pelepasan listrik satelit. Temuan ini bisa jadi dasar sistem peringatan dini.
Elektron: partikel kecil penyusun atom yang punya peran besar dalam listrik, teknologi, dan kehidupan sehari-hari. Pelajari lebih lanjut!
Untuk mengingat kembali inti pelajaran tersebut, berikut rangkuman Bab 8 tentang Partikel Penyusun Benda dan Makhluk Hidup. Silakan disimak kembali.
Observatorium HESS di Namibia berhasil mendeteksi elektron kosmik paling energik yang pernah diamati, dengan energi hingga 40 TeV.
ATOM-ATOM dengan nomor atom 1 sampai 18 akan stabil bila kulit atom terluarnya berisi 8 elektron. Unutk itu, suatu atom dapat melepaskan atau menerima satu atau lebih elektron.
UNTUK mengetahui cara atom-atom berikatan, kamu harus mempelajari susunan elektron di dalam suatu atom atau yang disebut konfigurasi elektron. Berikut uraian tentang konfigurasi elektron.
Penelitian terbaru mengungkap fakta mengejutkan: beberapa spesies buaya purba berevolusi menjadi herbivora, memakan tumbuhan, berbeda dari buaya modern yang karnivora.
ilmuwan menemukan fosil hewan darat pemakan tumbuhan yang hidup sekitar 307 juta tahun lalu di Kanada.
Tiga rahang, termasuk satu milik anak-anak, gigi, tulang belakang, dan tulang paha ditemukan di sebuah gua yang dikenal sebagai Grotte à Hominidés di Thomas Quarry di Casablanca, Maroko
Jurnal Nature, mengungkap temuan fosil manusia purba berusia sekitar 770 ribu tahun di Grotte à Hominidés, sebuah gua di wilayah barat daya Casablanca, Maroko.
Penemuan ini merupakan buah dari penantian panjang. Pada tahun 2009, para ilmuwan menemukan fosil kaki berusia 3,4 juta tahun dengan struktur jari yang dirancang untuk memanjat pohon.
Fosil legendaris Homo erectus atau yang dikenal luas sebagai Java Man kini telah resmi dipamerkan untuk publik di Museum Nasional Indonesia, Jakarta.
Copyright @ 2026 Media Group - mediaindonesia. All Rights Reserved
