Headline
SERANGAN brutal dan mematikan dari Israel-Amerika Serikat (AS) ke Iran pada Sabtu (28/2) lalu membuat dunia terhenyak.
SERANGAN brutal dan mematikan dari Israel-Amerika Serikat (AS) ke Iran pada Sabtu (28/2) lalu membuat dunia terhenyak.
 Kumpulan Berita DPR RI
Kumpulan Berita DPR RI
TERHITUNG delapan bulan sudah pandemi COVID-19 menjadi isu kesehatan global yang masih belum terselesaikan. Selama kurun waktu tersebut, belum ada jenis terapi farmakologi yang secara defi nitif efektif mengatasi virus penyebabnya. Meningkatnya angka kematian (case fatality rate) karena kasus COVID-19
menyebabkan ketersediaan vaksin COVID-19 menjadi kebutuhan yang mendesak
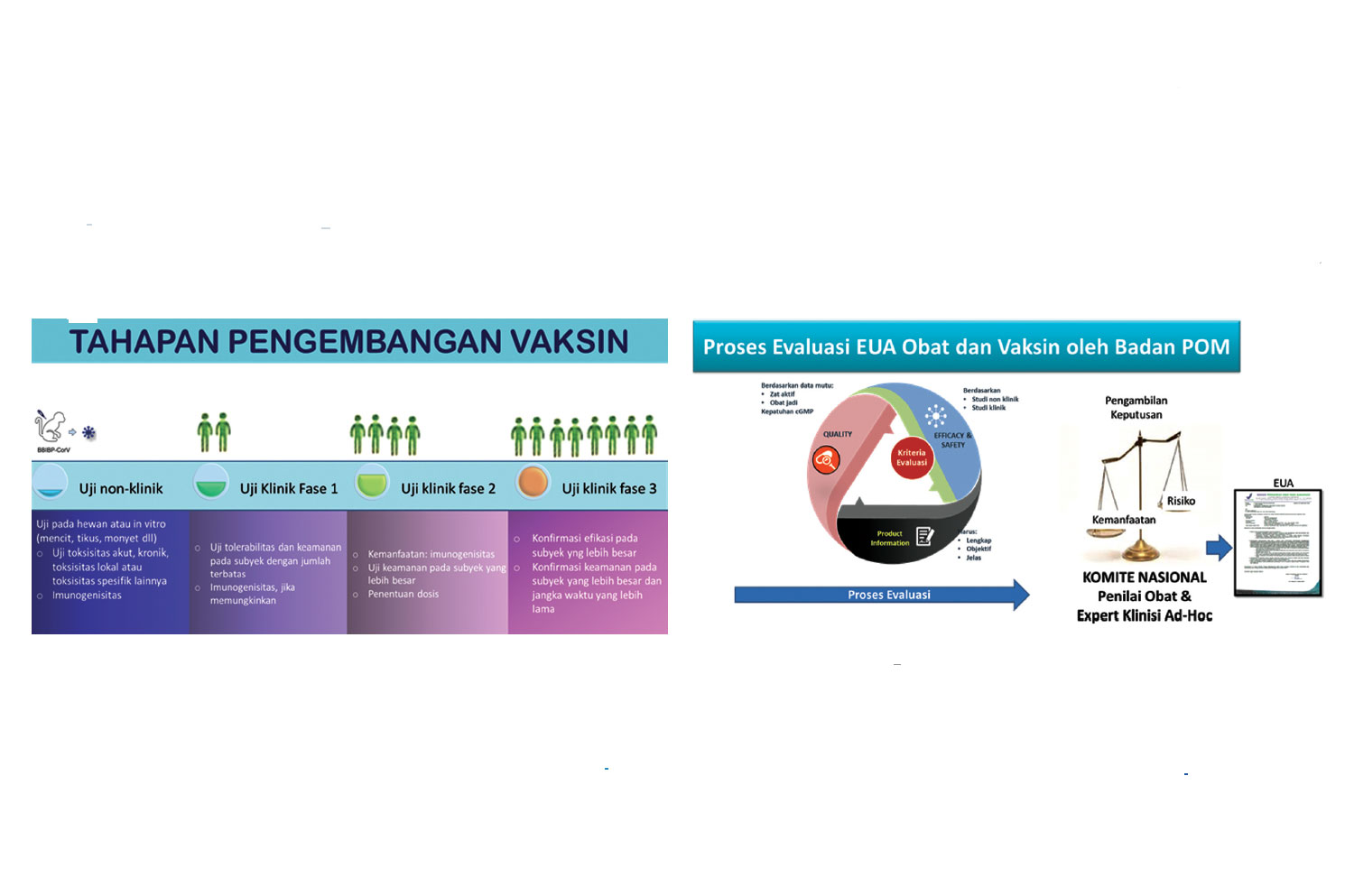
Proses penemuan produk vaksin baru merupakan perjalanan yang panjang. Seperti halnya menemukan senyawa obat baru yang memiliki fungsi dalam terapi suatu penyakit, perlu ada tahap uji pra-klinik dan uji klinik yang membutuhkan waktu lama. Untuk membuktikan khasiat dan keamanan vaksin dibutuhkan waktu beberapa tahun sampai vaksin siap digunakan di masyarakat.
Lalu bagaimana dengan vaksin COVID-19 yang baru memulai proses uji kliniknya di pertengahan tahun 2020 dan diharapkan dapat digunakan secara massal di awal tahun 2021? Poin penting yang mungkin masih menjadi pertanyaan dari masyarakat, apakah durasi tersebut memungkinkan untuk dapat menghasilkan vaksin yang aman digunakan dan efektif dalam mengatasi pandemi COVID-19?
Kepala Badan POM RI, Penny K. Lukito menyatakan bahwa hal tersebut memungkinkan terjadi. Pada kondisi normal, setiap tahapan proses pengembangan
obat dilakukan secara berurutan. Akan tetapi, pada kondisi pandemi COVID-19 seperti saat ini, maka pengembangan dilakukan melalui proses paralel untuk setiap tahap pengembangannya.
“Normalnya, tahap uji klinik produk vaksin baru dilakukan secara berurutan mulai dari uji klinik fase 1, fase 2, dan fase 3. Uji klinik fase 2 baru dapat dilaksanakan jika seluruh hasil uji klinik fase 2 selesai, dan seterusnya untuk uji klinik fase 3. Ini yang menyebabkan waktu pengembangan produk baru menjadi
lama. Pada kondisi pandemi ini, proses uji klinik ketiga fase tersebut dapat dilakukan secara paralel, tanpa menunggu masing-masing tahapan selesai terlebih dahulu. Uji klinik fase 2 dan fase 3 dapat dimulai tanpa menunggu fase 1 selesai, sepanjang hasil penyuntikan pada fase 1 tidak ada isu terkait keamanannya
dan telah menunjukkan bukti khasiat meski masih terbatas. Jadi waktu uji klinik bisa lebih cepat,” jelas Kepala Badan POM.
Proses tersebut, menurut Kepala Badan POM lagi, berlaku secara global dan dinilai aman serta masih sesuai dengan kaidah ilmiah pengembangan vaksin. Di samping itu, industri pengembang vaksin di masa pandemi ini menggunakan platform pengembangan yang sama dengan kemampuan industri tersebut, sehingga sudah memiliki pengalaman dalam pengembangannya dan tidak memerlukan infrastruktur baru.
“Mengingat kondisi pandemi global COVID-19, maka proses pengembangan vaksin untuk penanganan COVID-19 perlu dipercepat agar masyarakat dapat sesegera mungkin mendapatkan akses terhadap vaksin tersebut,” tegas Kepala Badan POM.
KEAMANAN DAN EFEKTIVITAS VAKSIN COVID-19
Saat ini, proses uji klinik yang dilakukan di Indonesia terhadap kandidat vaksin COVID-19 produksi Sinovac masih terus berlangsung. Uji klinik ini adalah uji klinik multicenter yang dilakukan di lima negara dengan melibatkan lebih dari 15.000 subjek.
Sebagai otoritas pengawas obat, Badan POM terus mengawal proses uji klinik (clinical trial oversight) mulai dari pemberian Persetujuan Protokol Uji Klinik (PPUK) hingga pengawalan melalui inspeksi agar pelaksanaan uji klinik selalu memenuhi Cara Uji Klinik yang Baik (CUKB), untuk menghasilkan data yang valid.
“Saat ini seluruh subjek uji klinik telah selesai direkrut dengan target 1.620 dan telah mendapatkan 2x suntikan. Tidak terdapat laporan kejadian efek samping yang serius akibat pemberian vaksin uji Sinovac ini,” lanjutnya.
Sekalipun demikian, efek samping ringan dan sedang yang umum di alami setelah proses vaksinasi tetap berpotensi muncul, seperti rasa nyeri di sekitar bagian tubuh yang disuntik, ruam, kemerahan pada kulit, atau demam ringan. Efek ini merupakan reaksi yang wajar sebagai bentuk respons tubuh terhadap
benda asing yang masuk ke dalam tubuh.
Selain mengawasi pelaksanaan uji klinik, aspek lain yang perlu dikontrol adalah terkait proses produksi dari vaksin yang digunakan selama proses uji klinik
maupun yang nantinya akan beredar dan digunakan di Indonesia. Terkait hal ini, Badan POM juga sedang melakukan inspeksi Cara Produksi Obat yang Baik (CPOB) pada sarana produksi vaksin Sinovac di Tiongkok. Menurut Kepala Badan POM, inspeksi tersebut dilakukan untuk memastikan kepatuhan pemenuhan standar CPOB oleh produsen, yang sekaligus menunjang penjaminan mutu vaksin yang dihasilkan.
Hal yang perlu menjadi catatan adalah bahwa tidak semua vaksin dapat memberikan proteksi pada 100% populasi. Vaksin yang dianggap baik biasanya memberikan proteksi terhadap penyakit pada minimum 70% populasi. Selain juga tergantung dari durasi respons imun/kekebalan tubuh yang dihasilkan oleh vaksin tersebut. Demikian pula halnya dengan vaksin untuk COVID-19 ini, efektivitas vaksin akan tergantung dari seberapa besar khasiat vaksin untuk menimbulkan proteksi terhadap virus SARS COV-2 dan dipengaruhi pula oleh respons imun tubuh dari pasien penerima vaksin.
PERSETUJUAN PENGGUNAAN VAKSIN COVID-19 DALAM KONDISI DARURAT
Setelah uji klinik selesai, maka hasil uji klinik akan digunakan dalam proses pendaftaran vaksin ke Badan POM untuk memperoleh izin edar. Selama masa pandemi ini, untuk memberikan kecepatan akses vaksin untuk digunakan oleh masyarakat, Badan POM memiliki prosedur persetujuan penggunaan obat/vaksin yang khusus diberikan untuk kondisi kedaruratan, yaitu Persetujuan Penggunaan Dalam Kondisi Darurat atau Emergency Use Authorization (EUA).
EUA dapat diberikan untuk obat/vaksin yang belum mendapatkan izin edar atau obat yang telah mendapatkan izin edar, namun dengan indikasi penggunaan yang berbeda (indikasi baru) untuk kondisi kedaruratan masyarakat. EUA dapat diberikan untuk obat/vaksin tertentu apabila memenuhi beberapa kriteria, yaitu adanya kondisi kedaruratan kesehatan yang telah ditetapkan oleh Pemerintah, terdapat cukup bukti ilmiah terkait aspek keamanan dan khasiat obat/vaksin
untuk penanganan penyakit terkait, obat/vaksin memiliki mutu sesuai standar yang berlaku dan diproduksi sesuai Cara Pembuat an Obat yang Baik (CPOB), menunjukkan kemanfaatan yang lebih besar dari risiko (risk-benefi t analysis), serta belum ada alternatif pengobatan atau tatalaksana yang memadai dan
disetujui untuk penanganan kondisi kedaruratan kesehatan masyarakat tersebut.
EUA diberikan dengan tetap memperhatikan aspek keselamatan manusia serta khasiat dan kualitas obat/vaksin. Prosedur EUA di Indonesia juga telah mengacu pada pedoman persetujuan darurat dari World Health Organization (WHO Emergency Use Listing), Emergency Use Authorization dari United States Food and Drug Administration (US FDA), dan Conditional Approval dari European Medicines Agency (EMA).
Evaluasi obat/vaksin untuk persetujuan EUA juga mengacu pada standar pedoman evaluasi nasional dan internasional sebagaimana pada proses evaluasi untuk registrasi obat/vaksin saat kondisi normal. Serta melalui tahap pembahasan dalam rapat Komite Nasional Penilai Obat yang melibatkan ahli dari berbagai bidang ilmu dan klinisi yang terkait untuk pertimbangan risiko dan kemanfaatan obat/vaksin tersebut untuk diberikan persetujuan.
“Pada keadaan darurat seperti pandemi COVID-19 saat ini, otoritas di bidang obat mengeluarkan izin penggunaan darurat dengan beberapa fl eksibilitas, antara lain adanya data interim report uji klinik fase 3,” ungkap Kepala Badan POM. “Fleksibilitas ini diperlukan untuk mempercepat akses obat/vaksin oleh
masyarakat. Apabila harus menunggu hasil uji klinik fase 3 selesai secara lengkap dapat mengakibatkan keterlambatan akses terhadap obat/vaksin tersebut,” lanjutnya.
“Proses evaluasi EUA secara prinsip sama dengan proses evaluasi pada registrasi vaksin normal. Hanya saja prosesnya lebih cepat, maksimum 20 hari kerja. Beberapa tahapan evaluasi dilakukan secara paralel dan dilakukan dengan mobilisasi sumber daya yang ada. EUA bukan merupakan pengganti izin edar, melainkan hanya berupa persetujuan untuk penggunaan di masa kedaruratan. Jika masa kedaruratan dicabut oleh pemerintah, maka obat/vaksin yang
mendapat EUA harus didaftarkan untuk memperoleh izin edar,” jelas Kepala Badan POM.
Pengawasan Distribusi Vaksin COVID-19
Proses distribusi vaksin COVID-19 di Indonesia akan terus berada di bawah pengawasan ketat Badan POM. Kepala Badan POM memastikan bahwa pihaknya akan berperan penuh dalam pengawasan tersebut mulai dari hulu hingga ke hilir. “Mulai dari proses pengadaannya melalui importasi, Badan POM akan terbitkan Surat Keterangan Impor. Setibanya di Indonesia, vaksin juga akan di-sampling oleh petugas untuk diterbitkan sertifikat pelulusan bets (lot release),” jelas Kepala Badan POM.
“Selanjutnya setelah vaksin beredar, Badan POM melakukan pengawasan antara lain dari sisi penyaluran dari industri farmasi serta kesesuaian rantai distribusi vaksin dari Pedagang Besar Farmasi sesuai Cara Distribusi Obat yang Baik (CDOB) dan di sarana pelayanan kefarmasian sesuai Standar Pelayanan Kefarmasian. Terutama terkait pengelolaan vaksin sebagai Cold Chain Product (CCP) karena vaksin memerlukan kondisi penyimpanan khusus pada suhu antara 2 – 8 derajat celcius, bahkan ada juga yang harus disimpan dalam kondisi beku (hingga minus 75 derajat celcius),” tambahnya.
Industri farmasi pemegang EUA juga diwajibkan untuk melakukan uji klinik lanjutan (uji klinik fase 4) terhadap vaksin yang masih dalam proses penelitian tersebut. Uji klinik fase 4, atau yang biasa disebut pemantauan farmakovigilans, merupakan kegiatan pemantauan dan pelaporan Kejadian Tidak Diinginkan
atau efek samping obat/vaksin pada pasien oleh dokter dan tenaga kesehatan lainnya di fasilitas pelayanan kesehatan serta oleh industri farmasi pemilik produk. Dalam farmakovigilans, industri farmasi maupun tenaga kesehatan melakukan pelaporan efek samping obat maupun Kejadian Ikutan Pasca Imunisasi (KIPI) kepada Pusat Farmakovigilans Nasional di Badan POM. Semua laporan yang diterima oleh Badan POM akan dievaluasi secara periodik dan dapat menjadi pertimbangan terhadap EUA yang sebelumnya telah diberikan. Evaluasi tersebut dilakukan bekerja sama dengan Tim Komite Nasional Penilai Obat dan khususnya untuk vaksin, Badan POM bekerja sama dengan Indonesian Technical Advisory Group on Immunization (ITAGI).
“Selain itu, industri farmasi harus melakukan pelaporan efek samping vaksin serta melaporkan realisasi importasi, produksi, dan distribusi vaksin selama persetujuan penggunaan darurat kepada Badan POM,” ungkap Kepala Badan POM.
“Jika dari pemantauan farmakovigilans diperoleh data peningkatan frekuensi efek samping dari penggunaan vaksin COVID-19, maka Badan POM dapat melakukan tindak lanjut. Dapat berupa komunikasi risiko ataupun pencabutan EUA. Hal ini dilakukan dalam rangka meningkatkan kehati-hatian dalam penggunaan dan perlindungan kesehatan masyarakat,” lanjut Kepala Badan POM.
Kelancaran distribusi vaksin COVID-19 untuk mempertahankan mutu vaksin sampai pada saat penyuntikan adalah tanggung jawab Bersama. Oleh karena itu, diperlukan kerja sama dari lintas sektor terkait, di antaranya Kementerian Perhubungan, Dinas Kesehatan Provinsi, dan Dinas Kesehatan Kabupaten/
Kota.
“Kami harap semua pihak yang terlibat agar memahami proses distribusi dan pengelolaan vaksin serta terlibat aktif dalam pengawasannya, sehingga pengelolaan vaksin dapat berjalan sesuai ketentuan untuk meminimalisir penurunan/kerusakan mutu vaksin yang akan berpengaruh pada khasiat dan keamanan vaksin.” tutup Kepala Badan POM.
Vaksin Merah Putih
Untuk kemandirian vaksin di Indonesia, Kementerian Riset dan Teknologi/ Badan Riset dan Inovasi Nasional (Kemenristek/BRIN) membentuk Konsorsium Pengembangan Vaksin Merah Putih. Konsorsium ini diperkuat dengan Keputusan Presiden RI No. 18 Tahun 2020 Tentang Tim Nasional Percepatan Pengembangan Vaksin Corona Virus Disease 2019 (COVID-19). Pengembangan vaksin tersebut dilakukan oleh Lembaga Biologi Molekuler Eijkman, di bawah koordinasi Kemenristek bekerja sama dengan Lembaga Ilmu Pengetahuan Indonesia (LIPI), badan POM, dan beberapa Perguruan Tinggi di Indonesia.
Vaksin Merah Putih dikembangkan menggunakan isolat virus SARS COV-2 yang beredar di Indonesia dari berbagai platform. Saat ini, Vaksin Merah Putih sudah mulai memasuki tahap uji pra-klinik dan ditargetkan untuk dapat segera dilakukan formulasi dan produksi dalam rangka uji klinik pada Januari 2021. Apabila progress pengembangan sesuai dengan rencana, maka diperkirakan Vaksin Merah Putih dapat diproduksi dalam jumlah besar pada triwulan keempat tahun 2021.
Dalam pertemuan dengan Presiden RI, Joko Widodo pada awal September lalu, Presiden menekankan bahwa penemuan dan produksi Vaksin Merah Putih menjadi salah satu poin penting dalam penanganan krisis kesehatan maupun krisis ekonomi akibat pandemi COVID-19. Pengembangan vaksin ini menjadi bentuk tanggung jawab Pemerintah dalam memenuhi kebutuhan masyarakat terhadap vaksin COVID-19. Selain itu, juga dapat menjadi momentum bagi bangsa
Indonesia untuk menunjukkan kemampuan dan kemandiriannya dalam mengembangkan vaksin yang berpotensi tidak hanya untuk digunakan di dalam negeri, tetapi juga untuk digunakan oleh negara lain. Berbagai upaya yang dilakukan oleh pemerintah dan berbagai pihak tersebut tidak akan optimal dalam penanganan pandemi COVID-19 tanpa adanya peran aktif masyarakat. Masyarakat harus selalu disiplin mematuhi protokol kesehatan di mana pun berada. ***
Bertepatan dengan peringatan Hari Kesehatan Nasional (HKN) di 2025, Daya Group bersama seluruh anak perusahaannya melaksanakan rangkaian kegiatan CSR yang berfokus pada bidang kesehatan.
Kegiatan ini menjadi bentuk apresiasi kepada pelanggan dan mitra yang telah menjadi bagian dari perjalanan selama lebih dari tiga dekade.
Diraihnya dua rekor Muri ini menjadi pengakuan nasional atas kiprah Ayu Widyaningrum di bidang estetika medis yang sudah digelutinya sejak 12 tahun lalu.
Bertepatan dengan Hari Kesehatan Nasional yang jatuh 12 November 2025, Kementerian Kesehatan menggelar Rapat Koordinasi Nasional Percepatan Penurunan Stunting.
Dalam rangka memperingati Hari Kesehatan Nasional (HKN) 2025, PT Asabri (Persero) menegaskan komitmennya untuk menjaga kesehatan seluruh peserta secara berkelanjutan.
PERINGATAN Hari Kesehatan Nasional 2025 di Kabupaten Klaten, Jawa Tengah, digelar dengan upacara bendera di halaman pendapa kabupaten dan dipimpin oleh Bupati Hamenang Wajar Ismoyo.
Riset terbaru menunjukkan vaksin Covid-19 berbasis mRNA seperti Pfizer dan Moderna dapat memicu sistem imun melawan sel kanker.
DUA tenaga kesehatan menerima vaksin Covid-19 di hari yang sama, pola respons antibodi setiap orang ternyata berbeda-beda menentukan berapa lama perlindungan vaksin bertahan
Pengurus IDI, Iqbal Mochtar menilai bahwa kekhawatiran masyarakat terhadap vaksin berbasis Messenger Ribonucleic Acid (mRNA) untuk covid-19 merupakan hal yang wajar.
Menteri Kesahatan AS Robert F. Kennedy Jr. membuat gebrakan besar dengan mencabut kontrak dan membatalkan pendanaan proyek vaksin berbasis teknologi mRNA, termasuk untuk covid-19.
Sejalan dengan penjelasan Kementerian Kesehatan yang menyebutkan vaksinasi booster covid-19 tetap direkomendasikan.
Pemakaian masker, khususnya di tengah kerumunan mungkin dapat dijadikan kebiasaan yang diajarkan kepada anak-anak.
Copyright @ 2026 Media Group - mediaindonesia. All Rights Reserved