Headline
Buka puasa bersama bukan sekadar rutinitas seremonial.
Buka puasa bersama bukan sekadar rutinitas seremonial.
 Kumpulan Berita DPR RI
Kumpulan Berita DPR RI
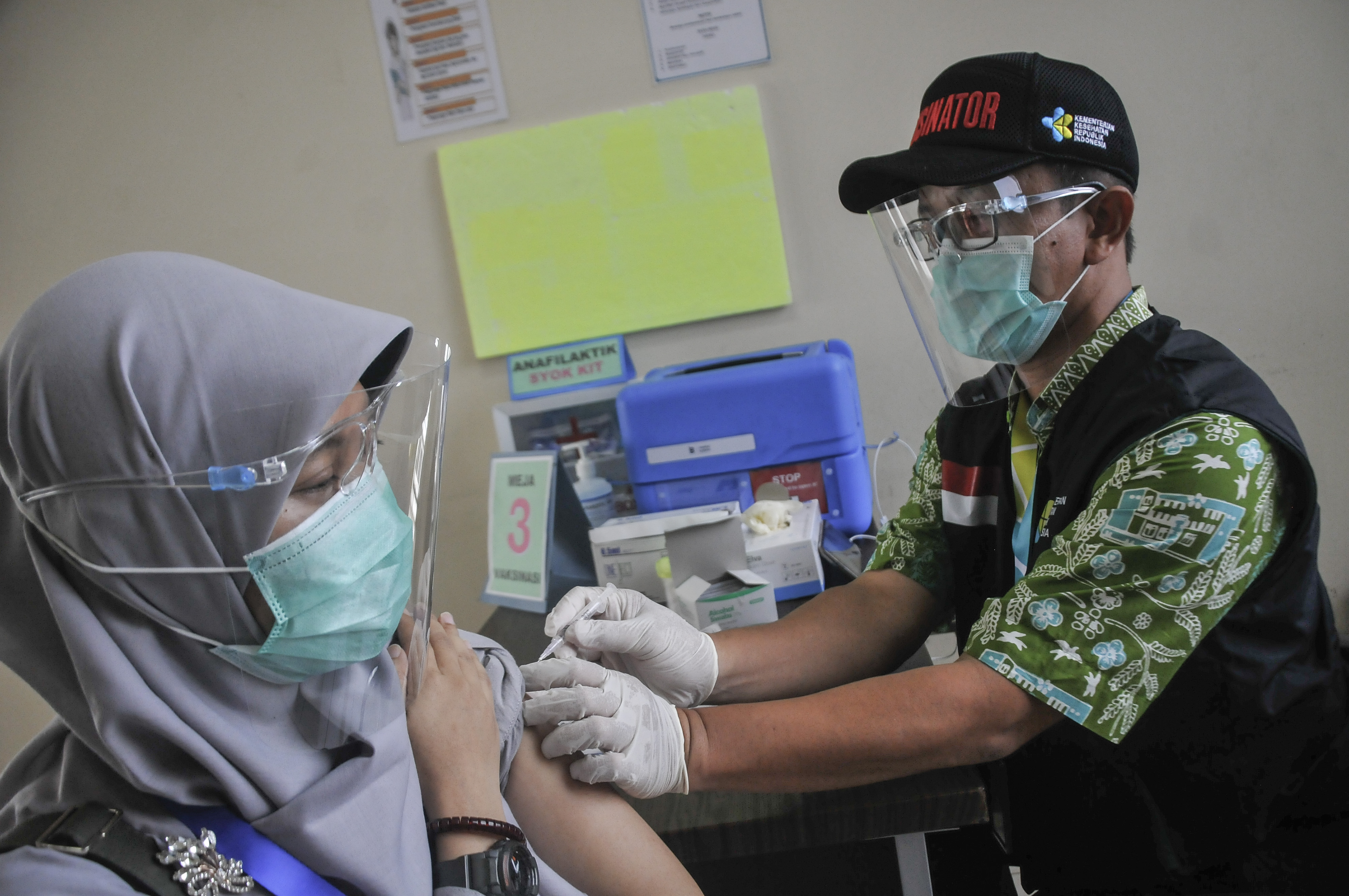
BADAN Pengawasan Obat dan Makanan (POM) terus mengawal pelaksanaan uji klinik vaksin sinovac, yang sekarang di tahap 3, mulai dari percepatan proses evaluasi dalam rangka pemberian Persetujuan Protokol Uji Klinik (PPUK) hingga pelaksanaan inspeksi untuk memastikan pelaksanaan uji klinik sesuai dengan protokol yang disetujui dan ketentuan pelaksanaan Cara Uji Klinik yang Baik (CUKB) atau Good Clinical Practice.
“Untuk dapat diterbitkan persetujuan penggunaan atau izin edar, vaksin harus memenuhi persyaratan keamanan, khasiat, dan mutu sesuai standar yang telah ditetapkan. Data khasiat dan keamanan diperoleh dari hasil uji klinik, sementara data mutu diperoleh dari pemenuhan spesifikasi produk vaksin dari bahan awal hingga produk jadi,” kata Kepala Badan POM RI, Penny K. Lukito saat konferensi terkait perkembangan uji klinik vaksin covid-19, Kamis (19/11).
Pemantauan terhadap keamanan subjek uji klinik juga dilakukan oleh Komite Etik Penelitian Kesehatan Univesitas Padjadjaran. “Dari hasil inspeksi yang dilakukan, sejauh ini uji klinik telah dilaksanakan dengan baik. Belum ada KTD atau efek samping serius yang dialami oleh subjek uji klinik,” sebut Penny.
Untuk mendukung data mutu uji klinik vaksin sinovac, Badan POM telah melakukan inspeksi ke fasilitas produksi Sinovac Life Science Beijing pada 2 hingga 5 November 2020. Inspeksi dilakukan secara komprehensif untuk memastikan produsen menerapkan standar Cara Pembuatan Obat yang Baik (CPOB) secara konsisten di sepanjang proses pembuatan vaksin, mulai dari pembuatan bahan baku vaksin (upstream), formulasi vaksin (downstream), hingga proses filling ke dalam vial menjadi produk jadi.
Selanjutnya, ujar Penny, keseluruhan data aspek keamanan, khasiat, dan mutu tersebut harus disampaikan oleh industri farmasi kepada Badan POM untuk dilakukan proses evaluasi yang mengacu pada standar pedoman evaluasi nasional dan internasional.
Proses evaluasi dilakukan oleh Badan POM melalui pembahasan bersama Komite Nasional Penilai Obat, tenaga ahli, dan klinisi dari Ikatan Dokter Indonesia. Khusus untuk vaksin, pembahasan dilakukan bersama ITAGI (Indonesia Technical Advisory Group on Immunization).
“Kami berharap agar PT. Biofarma dan Sinovac Biotech China berkomitmen untuk memenuhi data-data tersebut, sehingga pemberian izin dapat segera dilakukan oleh Badan POM sesuai dengan rencana vaksinasi yang ditetapkan oleh Pemerintah,” terang Penny.
Mengingat kebutuhan akan vaksin yang mendesak di masa pandemi ini, Badan POM memberikan fleksibilitas terkait penerbitan izin edar vaksin covid-19 melalui simplifikasi prosedur dan persyaratan, tanpa mengabaikan aspek keselamatan manusia dan kualitas vaksin. Dalam hal ini, izin dikeluarkan dalam bentuk perizinan penggunaan vaksin dalam kondisi darurat atau Emergency Use Authorization (EUA).
Kepala Badan POM menegaskan bahwa setelah vaksin mendapat persetujuan penggunaan, pengawalan mutu vaksin di sepanjang jalur distribusi nantinya akan menjadi tanggung jawab dari industri farmasi dan distributor yang ditunjuk. "Dalam proses penyaluran di sarana pemerintah diperlukan peran aktif berbagai pihak sesuai kewenangan masing-masing," paparnya.
Penny berharap semua pihak berkomitmen dan saling mendukung untuk bersama mengupayakan keberhasilan rencana pelaksanaan vaksinasi dalam rangka penanganan pandemi covid-19 di Indonesia.
Dalam pelaksanaan vaksinisasi nanti, Badan POM mengimbau masyarakat agar melaporkan kepada tenaga kesehatan di tempat memperoleh vaksinasi jika mengalami KTD setelah divaksin atau melaporkan secara langsung ke Badan POM melalui HaloBPOM 1500533 atau aplikasi BPOM Mobile.
Tenaga kesehatan juga diharapkan untuk dapat secara aktif melaporkan Kejadian Ikutan Pasca Imunisasi (KIPI) secara berjenjang kepada Komite Daerah KIPI–Komite Nasional KIPI melalui website keamanan vaksin www.keamananvaksin.kemkes.go.id dan kepada Pusat Farmakovigilans/MESO Nasional Badan POM melalui subsite https://e-meso.pom.go.id.(H-1)
BPOM perketat pengawasan Program Makan Bergizi Gratis karena risiko keamanan pangan. Sepanjang 2024 tercatat 138 KLB keracunan.
BPOM mengajak masyarakat menjadi konsumen cerdas dan berdaya dengan selalu menerapkan Cek KLIK (Kemasan, Label, Izin edar, dan Kadaluarsa) sebelum membeli atau mengonsumsi produk pangan.
BPOM mencatat, suplemen ilegal dapat berasal dari pabrik-pabrik tersembunyi yang beroperasi di tengah permukiman padat dengan kondisi yang jauh dari standar Cara Pembuatan yang Baik (CPB).
TPID bersama Satgas Pangan bertugas menjamin kecukupan pasokan dan kelancaran distribusi bahan pokok penting, sambil aktif mengedukasi masyarakat agar tidak melakukan penimbunan
Penghargaan ini diberikan sebagai bentuk apresiasi atas kemitraan dan keberhasilan Kosmesia dalam mendampingi UMKM kosmetik melalui Proaktif yang digagas BPOM.
Kolaborasi ini menegaskan komitmen bersama dalam membangun ekosistem distribusi produk yang aman, transparan, dan terpercaya.
Riset terbaru menunjukkan vaksin Covid-19 berbasis mRNA seperti Pfizer dan Moderna dapat memicu sistem imun melawan sel kanker.
DUA tenaga kesehatan menerima vaksin Covid-19 di hari yang sama, pola respons antibodi setiap orang ternyata berbeda-beda menentukan berapa lama perlindungan vaksin bertahan
Pengurus IDI, Iqbal Mochtar menilai bahwa kekhawatiran masyarakat terhadap vaksin berbasis Messenger Ribonucleic Acid (mRNA) untuk covid-19 merupakan hal yang wajar.
Menteri Kesahatan AS Robert F. Kennedy Jr. membuat gebrakan besar dengan mencabut kontrak dan membatalkan pendanaan proyek vaksin berbasis teknologi mRNA, termasuk untuk covid-19.
Sejalan dengan penjelasan Kementerian Kesehatan yang menyebutkan vaksinasi booster covid-19 tetap direkomendasikan.
Pemakaian masker, khususnya di tengah kerumunan mungkin dapat dijadikan kebiasaan yang diajarkan kepada anak-anak.
Copyright @ 2026 Media Group - mediaindonesia. All Rights Reserved