Headline
Tragedi Bantargebang menjadi bukti kegagalan sistemis.
 Kumpulan Berita DPR RI
Kumpulan Berita DPR RI
PERUSAHAAN Farmasi Takeda Pharmaceutical Company Limited (Takeda) mengajukan regulasi atas vaksin demam berdarah dengue (TAK-003)
kepada lembaga obat-obatan Eropa, European Medicines Agency (EMA).
Pengajuan regulasi dilakukan juga di Indonesia, Amerika Serikat, dan
sejumlah negara lainnya.
Pengajuan regulasi ini mencakup data keamanan dan kemanjuran jangka
panjang selama 36 bulan dari uji coba imunisasi Tetravalen fase 3
terhadap Studi Kemanjuran Demam Berdarah Dengue (Phase 3 Tetravalent
Immunization against Dengue Efficacy Study/TIDES).
Vice President and Global Dengue Program Head Takeda, Derek Wallace, mengatakan, kandidat vaksin TAK-003 tengah diteliti untuk pencegahan demam berdarah dengue (DBD) yang disebabkan serotipe virus pada individu berusia empat hingga 60 tahun.
Dengan pengajuan ini, pihaknya akan mempresentasikan dan mempublikasikan rincian data 36 bulan pada pertemuan ilmiah serta pada jurnal penelaahan sejawat (peer-review) di tahun ini. "Penyampaian pengajuan regulasi kandidat vaksin DBD TAK-003 menandai perkembangan penting bagi orang-orang yang tinggal atau bepergian ke berbagai komunitas yang terbebani oleh ancaman demam berdarah dengue," kata Wallace, Selasa (30/3).
Wallace melanjutkan, wabah DBD yang telah merenggut hidup setengah juta
orang di seluruh dunia setiap tahunnya dapat membuat pemerintah dan
masyarakat kewalahan karena dampaknya yang besar terhadap sistem
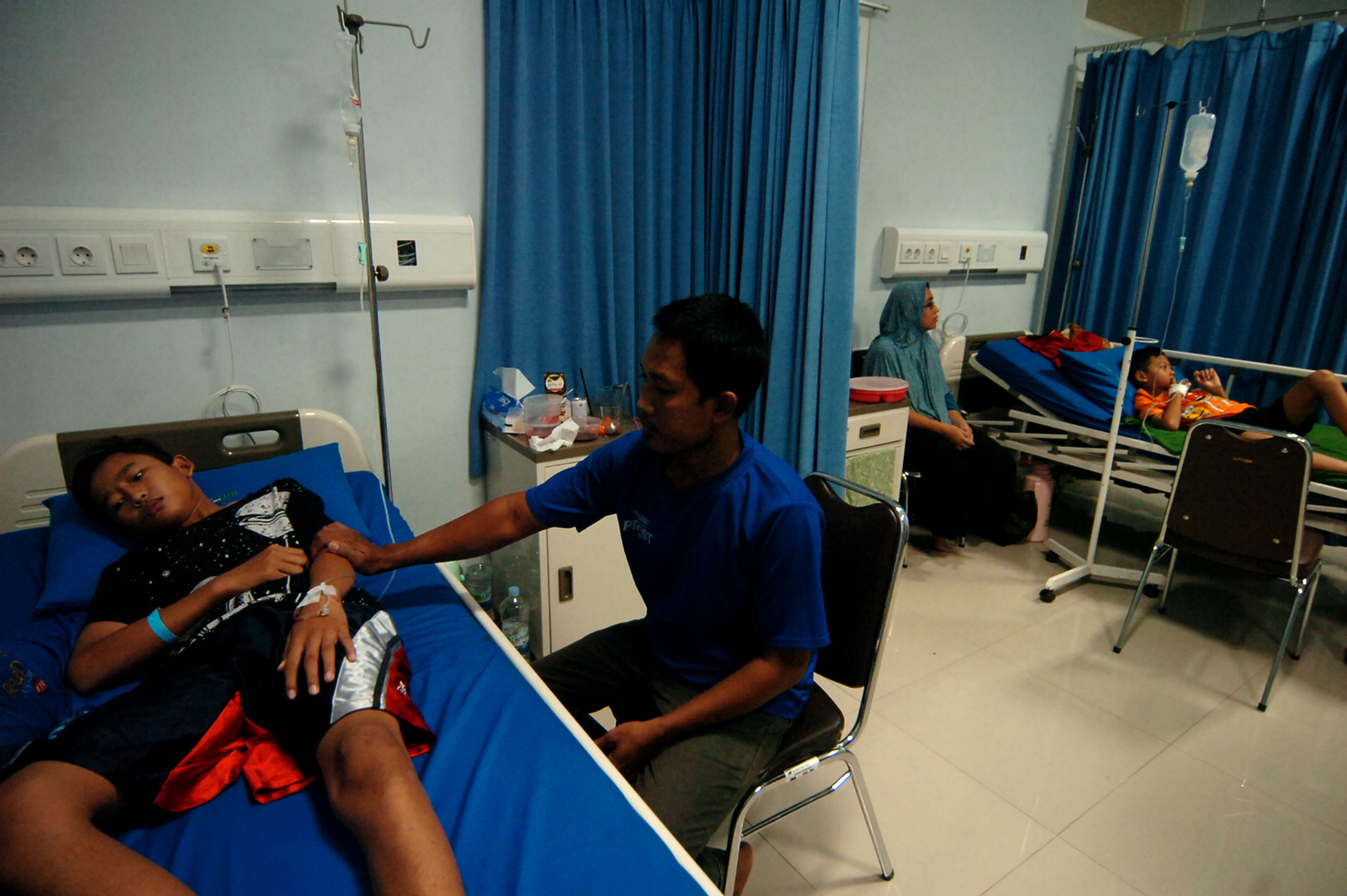
perawatan kesehatan. Di Indonesia kasus demam berdarah dengue
pada 2020 menimpa 95.893 warga dengan jumlah kematian sebanyak 661 orang.
Menurut Wallace, dengan terbatasnya pilihan yang ada untuk mencegah
penyakit tersebut, muncul kebutuhan yang mendesak atas vaksin DBD.
"Takeda berkomitmen untuk bekerja sama dengan otoritas regulator terkait serta lembaga pemberi rekomendasi untuk mendukung evaluasi atas
penyampaian regulasi kami dan memperoleh akses untuk vaksin TAK-003,"
katanya.
Takeda berpartisipasi dalam penilaian pararel pertama EMA atas pengunaan produk obat di Uni Eropa, dan menjalankan prosedur melalui EU-M4all (sebelum dikenal dengan Article 58) untuk negara-negara di luar kawasan Uni Eropa.
Bersamaan dengan opini ilmiah yang dikeluarkan oleh Committee for Medicinal Products for Human Use (CHMP), regulator di tingkat nasional dari negara-negara yang berpartisipasi dalam prosedur EU-M4all akan melakukan penilaian mereka sendiri untuk menentukan otorisasi pemasaran nasional untuk vaksin TAK-003 dapat diberikan.
"Takeda juga tengah meminta persetujuan atas vaksin TAK-003 pada
negara-negara endemik demam berdarah dengue yang tidak berpartisipasi
dalam prosedur EU-M4all," kata Wallace.
Uji coba
EU-M4all (Obat Uni Eropa untuk Semua) merupakan prosedur yang dirancang untuk memfasilitasi pasien dalam mengakses obat-obatan atau vaksin guna mencegah atau mengobati penyakit yang menjadi perhatian utama bidang kesehatan masyarakat.
Melalui prosedur EU-M4all (sebelumnya dikenal sebagai prosedur Article
58), lembaga EMA, berkerja sama dengan Organisasi Kesehatan Dunia (WHO), bisa memberikan opini ilmiah tentang obat-obatan dan vaksin untuk penyakit prioritas kesehatan masyarakat yang ditujukan untuk pasar di luar wilayah Uni Eropa.
Kandidat vaksin demam berdarah dengue tetravalent Takeda (TAK-003) dikembangkan berdasar pada virus serotipe 2 yang dilemahkan, yang akan menjadi tulang punggung genetis untuk keempat virus vaksin.
Data fase klinis 2 pada kelompok anak dan remaja menunjukan bahwa
TAK-003 menginduksi respons imun terhadap keempat serotipe demam berdarah dengue. Baik pada partisipan seropositive dan seronegative, yang bertahan hingga 48 bulan setelah vaksinasi, dan vaksin ditemukan secara umum aman dan ditoleransi dengan baik.
Uji coba yang penting di tahap 3 TIDES memenuhi titik akhir utamanya dari keseluruhan kemanjuran vaksin (Vaccine Efficacy/VE) terhadap DBD yang dikonfirmasi secara virologi (VCD) pada tindak lanjut 12 bulan dan semua titik akhir sekunder pada tindak lanjut 18 bulan. Terdapat beberapa kasus demam berdarah dengue, termasuk VE terhadap DBD yang dirawat di rumah sakit dan VE pada individu seropositive awal dan
seronegative awal. Khasiatnya bervariasi berdasarkan serotipe.
Hasilnya menunjukan bahwa TAK-003 secara umum dapat ditoleransi dengan
baik. Tidak terdapat risiko keselamatan penting yang diamati hingga
saat ini.
Uji coba fase 3 TIDES yang tersamar ganda, acak, dikontrolkan
plasebo tengah mengevaluasi keamanan dan kemanjuran dua dosis TAK-003
dalam pencegahan gejala DBD yang terkonfirmasi di laboratorium dengan semua tingkat keparahan dan yang disebabkan salah satu dari keempat serotipe virus pada kelompok anak dan remaja.
Amerika Latin dan Asia
Uji coba TIDES merupakan uji klinis intervensi terbesar Takeda hingga
kini yang melibatkan lebih dari 20.000 anak dan remaja sehat berusia
empat hingga 16 tahun. Mereka tinggal di daerah endemik demam berdarah
dengue.
Peserta penelitian secara acak menerima TAK-003 0,5 mL atau
plasebo dengan injeksi sub-kutan pada hari pertama dan hari ke-90.
Penelitian ini terdiri dari lima bagian.
Bagian 1 dan analisis titik akhir primer mengevaluasi kemanjuran vaksin
(VE) dan keamanan selama 15 bulan setelah dosis pertama (12 bulan
setelah dosis kedua). Bagian 2 dilanjutkan selama enam bulan tambahan
untuk menyelesaikan penilaian titik akhir sekunder VE berdasarkan
serotipe, status dasar dan tingkat keparahan penyakit, termasuk VE
terhadap demam berdarah yang dirawat di rumah sakit.
Bagian 3 mengevaluasi VE dan keamanan jangka panjang dengan mengamati
peserta selama dua setengah sampai tiga tahun. Bagian 4 akan
mengevaluasi keamanan selama 13 bulan setelah vaksinasi booster, dan
Bagian 5 akan mengevaluasi keamanan jangka panjang selama satu tahun
setelah menyelesaikan Bagian 4.
Uji coba berlangsung di sejumlah lokasi pada daerah-daerah endemik demam berdarah dengue di kawasan Amerika Latin, seperti Brazil, Kolombia, Panama Republik Dominika, dan Nikaragua. Di kawasan Asia dilakukan di Filipina, Thailand, dan Sri Lanka.
Wilayah-wilayah itu membutuhkan pencegahan demam berdarah. Di wilayah tersebut DBD adalah penyebab utama atas penyakit serius dan menimbulkan banyak kematian pada anak-anak.
Sampel darah dasar dikumpulkan dari semua individu yang berpartisipasi dalam uji coba untuk memungkinkan evaluasi keamanan dan kemanjuran berdasarkan serostatus. "Takeda dan Komite Pemantau Data Independen yang terdiri dari para ahli secara aktif memantau keselamatan
secara berkelanjutan," katanya. (N-2)
Indonesia menyambut baik rencana investasi dan kerja sama jangka panjang SINOVAC, termasuk di bidang riset dan pengembangan vaksin.
Prinsip dasar PHBS sebenarnya bersifat universal dan sederhana, yakni memastikan kebersihan tubuh dari unsur luar.
Cacar api bisa muncul saat imun menurun, terutama usia 50+. Ketahui waktu tepat vaksin herpes zoster (Shingrix), dosis, manfaat, dan siapa yang perlu konsultasi.
Ia menjelaskan, salah satu langkah pencegahan yang dilakukan adalah melakukan vaksinasi untuk kepada masyarakat.
Vaksin yang sedang diuji adalah V181-005, sebuah formulasi baru yang berpotensi memberikan perlindungan yang lebih cepat dan efisien.
Lucia menjelaskan ketika terjadi bencana banyak orang yang terkena luka bisa karena seng, paku, dan sebagainya maka diberikan serum anti tetanus, untuk mencegah infeksi.
Copyright @ 2026 Media Group - mediaindonesia. All Rights Reserved