Headline
Pada perdagangan kemarin, rupiah menguat tipis dan ditutup di level Rp16.936 per dolar AS.
Pada perdagangan kemarin, rupiah menguat tipis dan ditutup di level Rp16.936 per dolar AS.
 Kumpulan Berita DPR RI
Kumpulan Berita DPR RI
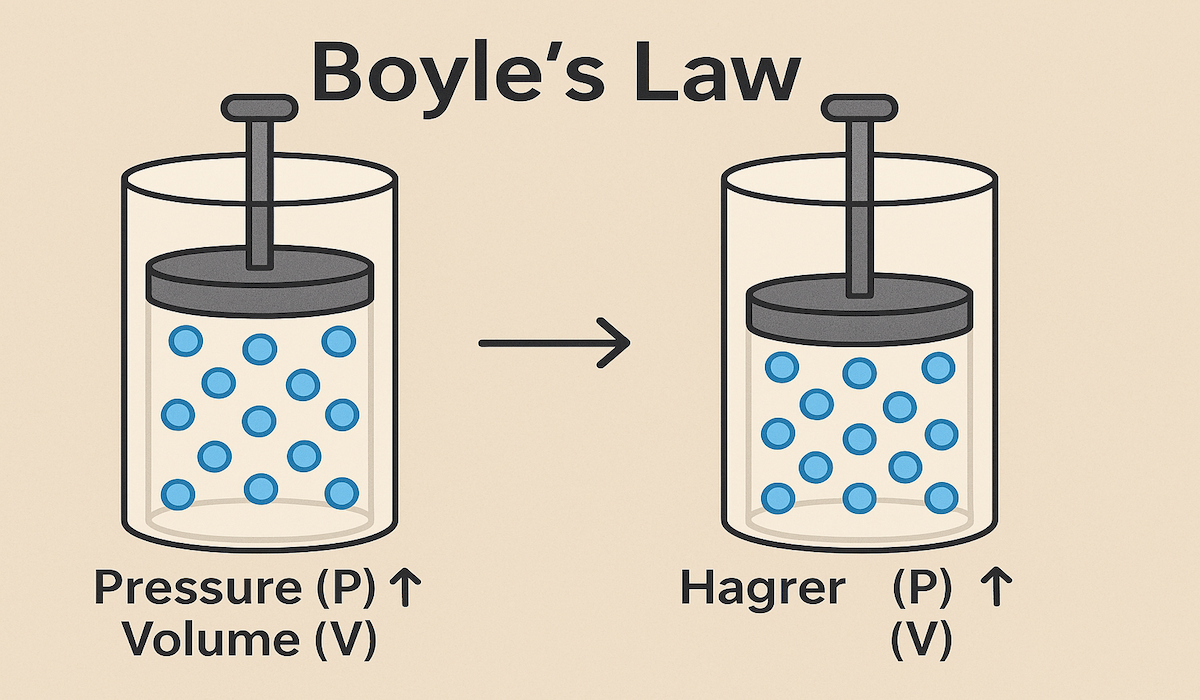
DALAM ranah fisika, terdapat berbagai hukum fundamental yang mengatur perilaku materi dan energi. Salah satu hukum yang paling mendasar dan penting dalam studi gas adalah Hukum Boyle. Hukum ini, yang dinamai dari ilmuwan Robert Boyle, menggambarkan hubungan terbalik antara tekanan dan volume gas pada suhu konstan.
Pemahaman mendalam tentang Hukum Boyle sangat penting dalam berbagai aplikasi, mulai dari desain mesin hingga pemahaman fenomena atmosfer.
Robert Boyle, seorang fisikawan dan kimiawan Irlandia yang hidup pada abad ke-17, melakukan serangkaian eksperimen penting yang membawanya pada penemuan hubungan antara tekanan dan volume gas. Eksperimen-eksperimen ini melibatkan penggunaan tabung berbentuk J yang diisi dengan merkuri untuk menjebak sejumlah udara.
Boyle kemudian mengamati bagaimana volume udara berubah seiring dengan perubahan tekanan yang diberikan oleh kolom merkuri. Melalui pengamatan yang cermat dan analisis data yang teliti, Boyle menyimpulkan bahwa tekanan dan volume gas berbanding terbalik satu sama lain, asalkan suhu gas tetap konstan.
Penemuan Boyle ini merupakan terobosan besar dalam pemahaman sifat-sifat gas. Sebelumnya, para ilmuwan memiliki pemahaman yang terbatas tentang bagaimana gas berperilaku. Hukum Boyle memberikan kerangka kerja matematis yang sederhana namun kuat untuk memprediksi dan menjelaskan perilaku gas dalam berbagai kondisi.
Hukum ini juga menjadi dasar bagi pengembangan hukum-hukum gas lainnya, seperti Hukum Charles dan Hukum Gay-Lussac.
Hukum Boyle dapat dinyatakan secara matematis sebagai berikut:
P1V1 = P2V2
di mana:
Persamaan ini menunjukkan bahwa hasil kali tekanan dan volume gas selalu konstan, asalkan suhu dan jumlah mol gas tetap konstan. Dengan kata lain, jika tekanan gas meningkat, maka volumenya akan menurun secara proporsional, dan sebaliknya.
Penting untuk dicatat bahwa Hukum Boyle hanya berlaku untuk gas ideal. Gas ideal adalah gas teoretis yang memenuhi asumsi-asumsi tertentu, seperti tidak adanya gaya tarik-menarik antar molekul gas dan volume molekul gas yang dapat diabaikan dibandingkan dengan volume wadah. Meskipun tidak ada gas yang benar-benar ideal di alam, banyak gas nyata mendekati perilaku ideal pada suhu dan tekanan yang relatif rendah.
Hukum Boyle memiliki berbagai aplikasi praktis dalam kehidupan sehari-hari. Beberapa contohnya meliputi:
Berikut adalah beberapa contoh soal yang melibatkan Hukum Boyle, beserta penyelesaiannya:
Soal 1: Sebuah gas memiliki volume 10 liter pada tekanan 2 atm. Jika tekanan gas ditingkatkan menjadi 4 atm, berapa volume gas tersebut, asalkan suhu tetap konstan?
Penyelesaian:
Menggunakan Hukum Boyle:
P1V1 = P2V2
Diketahui:
Ditanya: V2
Substitusikan nilai-nilai yang diketahui ke dalam persamaan:
(2 atm)(10 liter) = (4 atm)V2
Selesaikan untuk V2:
V2 = (2 atm)(10 liter) / (4 atm) = 5 liter
Jadi, volume gas tersebut adalah 5 liter.
Soal 2: Sebuah balon udara memiliki volume 500 liter pada tekanan atmosfer (1 atm). Jika balon tersebut naik ke ketinggian di mana tekanan atmosfer adalah 0,5 atm, berapa volume balon tersebut, asalkan suhu tetap konstan?
Penyelesaian:
Menggunakan Hukum Boyle:
P1V1 = P2V2
Diketahui:
Ditanya: V2
Substitusikan nilai-nilai yang diketahui ke dalam persamaan:
(1 atm)(500 liter) = (0,5 atm)V2
Selesaikan untuk V2:
V2 = (1 atm)(500 liter) / (0,5 atm) = 1000 liter
Jadi, volume balon tersebut adalah 1000 liter.
Meskipun Hukum Boyle merupakan alat yang berguna untuk memahami perilaku gas, penting untuk menyadari batasannya. Hukum Boyle hanya berlaku untuk gas ideal, dan gas nyata mungkin menyimpang dari perilaku ideal pada suhu dan tekanan yang ekstrem. Beberapa faktor yang dapat menyebabkan penyimpangan dari Hukum Boyle meliputi:
Untuk gas nyata, persamaan keadaan yang lebih kompleks, seperti persamaan Van der Waals, diperlukan untuk memprediksi perilaku gas dengan akurat.
Hukum Boyle merupakan bagian penting dari termodinamika, cabang fisika yang mempelajari hubungan antara panas, kerja, dan energi. Hukum Boyle dapat digunakan untuk menghitung kerja yang dilakukan oleh gas saat mengalami ekspansi atau kompresi isotermal (proses pada suhu konstan). Kerja yang dilakukan oleh gas selama ekspansi isotermal diberikan oleh persamaan:
W = -nRT ln(V2/V1)
di mana:
Persamaan ini menunjukkan bahwa kerja yang dilakukan oleh gas selama ekspansi isotermal berbanding lurus dengan jumlah mol gas, suhu gas, dan logaritma natural dari rasio volume akhir dan volume awal.
Hukum Boyle adalah prinsip dasar dalam fisika gas yang menggambarkan hubungan terbalik antara tekanan dan volume gas pada suhu konstan. Hukum ini memiliki berbagai aplikasi praktis dalam kehidupan sehari-hari, mulai dari penyelaman hingga pernapasan. Meskipun Hukum Boyle memiliki batasan tertentu, hukum ini tetap merupakan alat yang berguna untuk memahami perilaku gas dalam berbagai kondisi. Pemahaman mendalam tentang Hukum Boyle sangat penting bagi para ilmuwan, insinyur, dan siapa pun yang tertarik dengan sifat-sifat materi dan energi.
Setelah penemuan Hukum Boyle, para ilmuwan terus mengembangkan pemahaman mereka tentang perilaku gas. Hukum Charles, yang ditemukan oleh Jacques Charles pada tahun 1780-an, menggambarkan hubungan antara volume dan suhu gas pada tekanan konstan. Hukum Gay-Lussac, yang ditemukan oleh Joseph Louis Gay-Lussac pada awal abad ke-19, menggambarkan hubungan antara tekanan dan suhu gas pada volume konstan. Ketiga hukum ini, Hukum Boyle, Hukum Charles, dan Hukum Gay-Lussac, kemudian digabungkan menjadi Hukum Gas Ideal, yang dinyatakan sebagai:
PV = nRT
Hukum Gas Ideal memberikan deskripsi yang lebih komprehensif tentang perilaku gas daripada Hukum Boyle saja. Hukum ini berlaku untuk gas ideal dalam berbagai kondisi suhu dan tekanan. Namun, seperti Hukum Boyle, Hukum Gas Ideal juga memiliki batasan tertentu dan tidak berlaku untuk gas nyata pada suhu dan tekanan yang ekstrem.
Meskipun Hukum Boyle ditemukan berabad-abad yang lalu, hukum ini tetap relevan dalam konteks modern. Hukum Boyle digunakan dalam berbagai aplikasi teknologi, seperti:
Selain aplikasi teknologi, Hukum Boyle juga penting dalam pemahaman fenomena alam, seperti:
Untuk memahami Hukum Boyle dengan lebih baik, Anda dapat melakukan eksperimen sederhana di rumah. Berikut adalah salah satu contohnya:
Alat dan Bahan:
Langkah-langkah:
Hasil:
Anda akan melihat bahwa volume udara di dalam suntikan menurun saat Anda menambahkan lebih banyak buku atau benda berat di atas piston. Hal ini menunjukkan bahwa tekanan dan volume gas berbanding terbalik satu sama lain, sesuai dengan Hukum Boyle.
Penjelasan:
Saat Anda menambahkan buku atau benda berat di atas piston, Anda meningkatkan tekanan pada udara di dalam suntikan. Peningkatan tekanan ini menyebabkan volume udara menurun. Eksperimen ini memberikan demonstrasi visual yang sederhana tentang Hukum Boyle.
Ada beberapa kesalahpahaman umum tentang Hukum Boyle yang perlu diluruskan:
Dengan memahami batasan dan kesalahpahaman umum tentang Hukum Boyle, kita dapat menggunakan hukum ini dengan lebih efektif untuk memahami dan memprediksi perilaku gas.
Hukum Boyle bukan hanya sekadar persamaan matematis. Hukum ini adalah representasi dari hubungan fundamental antara tekanan dan volume gas. Memahami Hukum Boyle membantu kita memahami dunia di sekitar kita, dari cara kerja mesin hingga fenomena alam yang kompleks.
Dengan terus mempelajari dan menerapkan Hukum Boyle, kita dapat mengembangkan teknologi baru dan memecahkan masalah yang kompleks. (Z-10)
Copyright @ 2026 Media Group - mediaindonesia. All Rights Reserved